◆JW중외제약, 테라젝아시아와 마이크로니들 탈모치료제 공동연구 추진

JW중외제약은 마이크로니들 연구기업 테라젝아시아와 마이크로니들 탈모치료제 공동연구 협약을 체결했다고 25일 밝혔다. 이번 협약으로 JW중외제약 제제연구센터는 테라젝아시아의 플랫폼을 활용해 마이크로니들 탈모치료제 개발에 나선다.
이른바 ‘붙이는 주사’로 불리는 마이크로니들(Microneedle)은 머리카락 3분의 1 수준의 미세한 바늘로 피부를 통해 약물을 전달하는 경피약물전달 기술이다. 마이크로니들을 피부에 붙이면 미세 침이 피부를 뚫고 들어가 녹으면서 인체에 약물을 주입해 기존 주사제나 경구제를 대체할 수 있는 차세대 약물전달기술로 주목받고 있다.
특히 투약 편의성뿐만 아니라 주사제 대비 회복력이 빠르고 저렴한 비용으로 대량 생산할 수 있어 최근 관련 의약품 개발이 활발히 진행되고 있다. 시장조사기관 퓨처마켓인사이트에 따르면 2019년 6억2160만 달러였던 전 세계 마이크로니들 의약품 시장은 2030년 12억390만 달러 규모로 성장할 전망이다.
테라젝아시아는 2019년 미국 테라젝으로부터 전 세계 파마슈티컬 용해성 마이크로니들 원천 특허의 전용실시권을 확보하고, 2020년부터 의료용 패치의 상용화를 위한 표준화 기술연구 및 개발에 집중하고 있다. JW중외제약은 테라젝아시아와의 공동연구를 통해 전신 순환 및 국소 적용 의약품의 약효를 증진하고 주사제형의 투약 편의성을 개선할 수 있는 치료제를 개발할 계획이다.
◆삼성바이오로직스, 쿠르마파트너스와 파트너십 체결

삼성바이오로직스는 글로벌 바이오 헬스케어 벤처 캐피탈 쿠르마파트너스(Kurma Partners)社 와 투자 기업을 위한 바이오의약품 개발 및 생산 지원 파트너십을 체결했다고 24일 밝혔다.
이번 협약에 따라 삼성바이오로직스는 쿠르마파트너스가 투자하는 바이오테크 기업을 대상으로 맞춤형 위탁개발서비스(Contract Development Service)를 제공한다. 특히 지난 8월 출시한 '맞춤형 개발 솔루션(Customized CMC Solution)' 을 통해 각 후보물질의 특성과 개발전략에 따른 CMC프로그램을 제공해 해당 회사가 개발 초기단계부터(Early stage)부터 최적화된 서비스로 공정을 개발할 수 있도록 지원할 계획이다.
쿠르마파트너스는 유럽 최대 투자그룹인 유라지오 소속으로 2009년 설립되어 바이오 헬스케어 분야를 전문적으로 투자하는 벤처캐피탈이다. 현재는 유럽 시장을 기반으로 전세계 주요 바이오 클러스터의 제약사 들과 광범위한 네트워크를 확보하고 있다. 삼성바이오로직스는 이번 협약을 통해 글로벌 CDMO 리더로서 유망한 바이오테크와의 상생 사례를 늘리며 잠재 고객사와의 파트너십을 강화해 나간다는 방침이다.
이를 통해 향후 파트너사가 바이오의약품 개발 성공 시 전략적으로 협력해, 위탁개발(CDO)부터 위탁생산(CMO), 무균 충전 및 마감 공정에 이르는 삼성바이오로직스 엔드 투 엔드(End-to-End) 솔루션을 제공할 수 있는 기회를 높인다는 계획이다.
한편 삼성바이오로직스는 2018년 위탁개발(CDO) 사업에 진출해 5년 만에 100건 이상의 계약을 체결했으며, 최근에는 맞춤형 개발 솔루션(Customized CMC solutions) 서비스를 출시해 후보물질의 공정개발 서비스를 전임상 단계 뿐 아니라 후기 임상 단계까지 확대하는 등 차별화된 CDO서비스를 제공하고 있다.
◆대웅제약 펙수클루, 유럽서 소화기내과 세계적 권위자의 격찬 받아

대웅제약은 국산 34호 신약 ‘펙수클루’의 임상 데이터가 ‘2023 유럽소화기질환 학술대회(United European Gastroenterology Week 2023, UEGW 2023)’에 참석한 전세계 소화기 전문가들로부터 호평을 받았다고 24일 밝혔다. 지난 5월 미국에서 열린 ‘2023 소화기질환 주간’(Digestive Disease Week 2023, DDW 2023)’에서도 전문가들의 주목을 끈 바 있다.
대웅제약은 지난 16일(현지시간) 덴마크 코펜하겐에서 열린 ‘UEGW 2023’에서 국내외 주요 오피니언 리더(Key Opinion Leader)를 연사로 한 학술 심포지엄 '펙수클루 나잇(Fexuclue Reception Night)’을 열고 펙수클루의 강점과 임상 데이터를 소개했다.
이날 국내외 주요 오피니언 리더들은 펙수클루가 지닌 임상 데이터에 가장 큰 관심을 보였다. 이어 위식도역류질환 치료 패러다임이 기존 PPI(양성자 펌프 억제제)에서 보다 효과가 빠르고 강력한 P-CAB(칼륨 경쟁적 위산분비 억제제) 중심으로 전환될 것이라는 점에 공감했다.
임상 데이터에 따르면 펙수클루는 야간산분비(nocturnal acid breakthrough, NAB)로 인한 가슴쓰림 증상개선 효과를 입증했으며, 식사 여부 상관없이 위산을 빠르고 안정적으로 억제하며 최대 9시간의 반감기를 보여 효과 지속시간이 위식도역류질환 치료제 가운데 가장 길다.
대웅제약은 펙수클루의 강점을 해외에 지속적으로 알리고 2025년까지 품목허가 제출을 30개국으로 늘릴 계획이다. 현재 펙수클루의 해외 품목허가 신청 국가는 누적 12개국이며, 이 중 4개국(필리핀, 에콰도르, 칠레, 멕시코)에서 허가승인을 받았다. 대웅제약은 연내 누적 20개국까지 품목허가 신청 국가 수를 늘릴 계획이다.
◆삼양홀딩스, 대한비만미용학회 학술대회에서 ‘라풀렌’∙‘크로키’ 임상 증례 발표

삼양홀딩스 바이오팜그룹은 22일 서울 강남구 코엑스에서 열린 대한비만미용학회(KOAT, Korean academy of Obesity & Aesthetic Treatment) 추계 학술대회에서 생분해성 고분자 필러 ‘라풀렌’과 리프팅 실 ‘크로키’의 임상적 유효성과 안전성을 입증하는 임상 증례를 발표했다.
삼양홀딩스가 이번 학술대회에서 발표한 내용은 △라풀렌의 효과적이고 안전한 시술을 위한 가이드 및 임상 증례 △라풀렌과 크로키 병합 시술법을 통한 라풀렌의 특장점과 차별점 소개 △크로키의 안면부 리프팅 효과를 입증한 임상 증례 및 시술법 총 3가지다.
안면성형용 필러 라풀렌은 의료용 생분해성 고분자 물질인 폴리카프로락톤(PCL, Polycaprolactone)이 주성분으로 지속시간이 2년 이상 유지되며, 삼양홀딩스의 특허 기술이 적용돼 이물감이 적고 자연스러운 볼륨이 특징이다. 2021년 식품의약품안전처의 허가를 획득했으며, 과학기술논문인용색인(SCI)급 국제학술지에 장기 효과를 입증한 연구 결과가 게재되며 제품의 우수성을 인정받았다. 글로벌 시장에도 진출해 인도네시아 현지에 출시됐으며, 올해 5월에는 중국의 의료기기 및 에스테틱 전문기업과 수출 관련 파트너십 계약을 체결하기도 했다.
크로키는 일정 시간이 지나면 인체 내에서 자연적으로 분해되는 생분해성 리프팅 실로, 생체에 적합한 고분자물질인 폴리디옥사논(PDO, Polydioxanone)이 주성분이다. 생분해성 봉합사 원사 분야에서 글로벌 시장을 선도하고 있는 삼양홀딩스의 기술이 집약된 제품으로 2019년 유럽 의료기기 인증인 규정 CE MDD (Medical Devices Directive) 인증을 받았다. 현재까지 유럽, 일본, 중남미 등 전 세계 18개국 기업과 판매 계약을 체결했으며 미국에서는 시판 허가 절차를 진행중이다.
삼양홀딩스는 29일에는 대한필러학회에서 개최하는 제 23차 정기학술대회 및 국제필러학회 심포지움에도 참석해 라풀렌과 크로키의 병합 시술법을 소개하고 임상 증례를 발표할 계획이다.
◆셀트리온, ‘짐펜트라’ 美서 신약으로 최종 판매 허가 획득
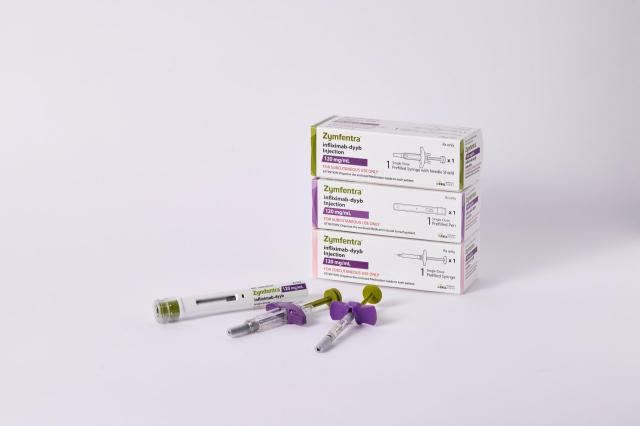
셀트리온이 개발한 세계 최초 항체 바이오시밀러 램시마(성분명: 인플릭시맙)의 피하주사(SC) 제형인 짐펜트라(ZYMFENTRA, 램시마SC 미국 브랜드명)가 20일(현지시간) 미국 식품의약국(FDA)으로부터 신약으로 판매 허가를 획득했다.
짐펜트라는 TNF-α 억제제 시장에서 강력한 경쟁력을 확보하기 위해 기존 정맥주사 제형인 램시마를 피하주사로 제형을 변경해 개발한 세계 유일의 인플릭시맙 SC제형 치료제다. 이미 램시마SC라는 브랜드로 유럽, 캐나다 등 약 50여개 국가에서 판매 허가를 획득하고 빠르게 점유율을 확대하고 있다.
미국에서는 FDA가 허가 협의 단계부터 제품의 차별성을 인정해 신약 허가 절차를 권고했다. 신약으로 승인받기 위해 셀트리온은 두 개의 신규 글로벌 3상 임상을 수행했고, 해당 임상들에서 입증된 안전성과 유효성 결과를 바탕으로 FDA의 신약 허가 절차에 따라 2022년 12월 허가 신청을 제출해 이번에 승인을 획득했다.
짐펜트라는 셀트리온이 미국 시장에서 신약으로 승인받은 첫 제품으로, 이미 출원 완료한 SC제형과 투여법에 대한 특허를 통해 최대 2040년까지 특허 보호를 받을 수 있을 것으로 기대된다. 해당 특허는 짐펜트라뿐 아니라 인플릭시맙 피하주사 바이오시밀러의 시장 진입을 방어할 수 있도록 구성된 장벽 특허로, 확보될 경우 만료시점까지 짐펜트라가 신약의 독점적 지위를 유지할 수 있다. 이에 셀트리온은 짐펜트라에 기존 바이오시밀러 대비 높은 판매가격을 책정할 수 있어 회사에도 안정적인 중장기적 수익 기반이 될 것으로 기대하고 있다.




















































댓글 더보기